






















EL ÁTOMO
Desde la Antigüedad, el ser humano se ha cuestionado de qué estaba hecha la materia. Unos 400 años antes de Cristo, el filósofo griego Demócrito consideró que la materia estaba constituida por pequeñísimas partículas que no podían ser divididas en otras más pequeñas. Por ello, llamó a estas partículas átomos, que en griego quiere decir "indivisible". Demócrito atribuyó a los átomos las cualidades de ser eternos, inmutables e indivisibles.
Sin embargo las ideas de Demócrito sobre la materia no fueron aceptadas por los filósofos de su época y hubieron de transcurrir cerca de 2200 años para que la idea de los átomos fuera tomada de nuevo en consideración.
Sin embargo las ideas de Demócrito sobre la materia no fueron aceptadas por los filósofos de su época y hubieron de transcurrir cerca de 2200 años para que la idea de los átomos fuera tomada de nuevo en consideración.
Modelo Atómico de Dalton
En 1808, Dalton publicó sus ideas sobre el modelo atómico de la materia las cuales han servido de base a la química moderna. Los principios fundamentales de esta teoría son:
| 1. La materia está formada por minúsculas partículas indivisibles llamadas átomos. 2. Hay distintas clases de átomos que se distinguen por su masa y sus propiedades. Todos los átomos de un elemento poseen las mismas propiedades químicas. Los átomos de elementos distintos tienen propiedades diferentes. |
 |
 | 3. Los compuestos se forman al combinarse los átomos de dos o más elementos en proporciones fijas y sencillas. De modo que en un compuesto los de átomos de cada tipo están en una relación de números enteros o fracciones sencillas. 4. En las reacciones químicas, los átomos se intercambian de una a otra sustancia, pero ningún átomo de un elemento desaparece ni se transforma en un átomo de otro elemento |
Modelo Atómico de Thomson
A comienzos del siglo XIX se presentaba la siguiente situación:
- Dalton había demostrado que la materia estaba formada por átomos.
- Existían experiencias de fenómenos eléctricos que demostraban que la materia podía ganar o perder cargas eléctricas.
Por tanto, esas cargas eléctricas debían de estar de alguna forma en el interior de los átomos. Si esto era cierto, la teoría de Dalton era errónea, ya que decía que los átomos eran indivisibles e inalterables.
Debido a que no podían verse los átomos, se realizaron experimentos con tubos de descarga o tubos de rayos catódicos y así, de esta manera, se observaron algunos hechos que permitieron descubrir las partículas subatómicas del interior del átomo.
Los tubos de rayos catódicos eran tubos de vidrio que contenían un gas a muy baja presión y un polo positivo (ánodo) y otro negativo (cátodo) por donde se hacía pasar una corriente eléctrica con un elevado voltaje.

El descubrimiento del electrón
Es la primera partícula subatómica que se detecta.
Thomson realizó experiencias en tubos de descarga de gases. Observó que se emitían unos rayos desde el polo negativo hacia el positivo, los llamó rayos catódicos.
Al estudiar las partículas que formaban estos rayos se observó que eran las mismas siempre, cualquiera que fuese el gas del interior del tubo. Por tanto, en el interior de todos los átomos existían una o más partículas con carga negativa llamadas electrones.
Modelo de Thomson
Al ser tan pequeña la masa de los electrones, Thomson propuso, en 1904, que la mayor parte de la masa del átomo correspondería a la carga positiva, que ocuparía la mayor parte del volumen atómico. Thomson imaginó el átomo como una especie de esfera positiva continua en la que se encuentran incrustados los electrones, más o menos como las uvas pasas en un pudin.

Este modelo del “pudin de pasas” de Thomson era bastante razonable y fue aceptado durante varios años, ya que explicaba varios fenómenos, por ejemplo los rayos catódicos y los canales:
El modelo de Thomson fue bastante valorado ya que era capaz de explicar los siguientes fenómenos:
La electrización: el exceso o defecto de electrones que tenga un cuerpo es el responsable de su carga negativa o positiva.
La formación de iones: Un ion es un átomo que ha ganado o perdido uno o más electrones. Los electrones se pierden o se ganan con relativa facilidad, de manera que su número dentro del átomo puede variar, mientras que el número de protones es fijo siempre para cada átomo.
Si un átomo pierde uno ó más electrones, adquiere carga neta positiva (catión) y si gana uno ó más electrones adquiere carga neta negativa (anión).
En 1911, Rutherford y sus colaboradores bombardearon una fina lámina de oro con partículas alfa (positivas), procedentes de un material radiactivo, a gran velocidad. El experimento permitió observar el siguiente comportamiento en las partículas lanzadas:
La mayor parte de ellas atravesaron la lámina sin cambiar de dirección, como era de esperar. Algunas se desviaron considerablemente. Unas pocas partículas rebotaron hacia la fuente de emisión.
 El comportamiento de las partículas no podía ser explicado con el modelo de Thomson, así que Rutherford lo abandonó y sugirió otro basado en el átomo nuclear.
El comportamiento de las partículas no podía ser explicado con el modelo de Thomson, así que Rutherford lo abandonó y sugirió otro basado en el átomo nuclear.
De acuerdo con el Modelo de Thomson, en el cual la carga positiva de cada átomo está distribuida de forma homogénea, las partículas positivas que atraviesan la lámina no deberían ser apreciablemente desviadas de su trayectoria inicial. Evidentemente, esto no ocurría. En el Modelo de Rutherford la carga positiva está concentrada en un núcleo central, de manera que las partículas positivas que pasan muy cerca de él, se desvían bastante de su trayectoria inicial y sólo aquellas pocas que chocan directamente con el núcleo regresan en la dirección de la que proceden.
El átomo tiene una zona central o núcleo donde se encuentra la carga total positiva y la mayor parte de la masa del átomo. Además presenta una zona externa o corteza donde se hallan los electrones, que giran alrededor del núcleo. (Realmente, las partículas del núcleo (protones y neutrones) se descubrieron después de que Rutherford estableciera su modelo. El experimento de Rutherford sólo informaba de un núcleo pequeño y positivo, no aclaraba nada más).
 La carga positiva es compensada con la carga negativa de los electrones, que se hallan fuera del núcleo. El núcleo contiene, por tanto, cargas positivas en un número igual al de electrones de la corteza.
La carga positiva es compensada con la carga negativa de los electrones, que se hallan fuera del núcleo. El núcleo contiene, por tanto, cargas positivas en un número igual al de electrones de la corteza.
El átomo estaba formado por un espacio fundamentalmente vacío, ocupado por electrones que giran a gran velocidad alrededor de un núcleo central muy denso y pequeño.
Mediante diversos experimentos se comprobó que la masa cargas positivas y electrones no coincidía con la masa total del átomo; por tanto, Rutherford supuso que tenía que haber otro tipo de partícula subatómica en el interior de los átomos.
Estas partículas se descubrieron en 1932. Al no tener carga eléctrica recibieron el nombre de neutrones.
En cambio la luz emitida por un gas incandescente no es blanca sino coloreada y el espectro que se obtiene al hacerla pasar a través de un prisma es bastante diferente. Es un espectro discontinuo que consta de líneas o rayas emitidas a longitudes de onda específicas. Cada elemento (es decir cada tipo de átomos) posee un espectro característico que puede utilizarse para identificarlo.
Uno de los espectros atómicos más sencillos, y que más importancia tuvo desde un punto de vista teórico, es el del hidrógeno. Cuando los átomos de gas hidrógeno absorben energía por medio de una descarga de alto voltaje, emiten radiaciones que dan lugar a 5 líneas en la región visible del espectro:
 Niels Bohr se basó en el átomo de hidrógeno para realizar el modelo que lleva su nombre. Bohr intentaba realizar un modelo atómico capaz de explicar la estabilidad de la materia y los espectros de emisión y absorción discretos que se observan en los gases.
Niels Bohr se basó en el átomo de hidrógeno para realizar el modelo que lleva su nombre. Bohr intentaba realizar un modelo atómico capaz de explicar la estabilidad de la materia y los espectros de emisión y absorción discretos que se observan en los gases.
Describió el átomo de hidrógeno con un protón en el núcleo, y girando a su alrededor un electrón. El modelo atómico de Bohr partía conceptualmente del modelo atómico de Rutherford y de las incipientes ideas sobre cuantización que habían surgido unos años antes con las investigaciones de Max Planck y Albert Einstein. Debido a su simplicidad el modelo de Bohr es todavía utilizado frecuentemente como una simplificación de la estructura de la materia.
 En este modelo los electrones giran en órbitas circulares alrededor del núcleo, ocupando la órbita de menor energía posible, o sea la órbita más cercana al núcleo posible. El electromagnetismo clásico predecía que una partícula cargada moviéndose de forma circular emitiría energía por lo que los electrones deberían colapsar sobre el núcleo en breves instantes de tiempo. Para superar este problema Bohr supuso que los electrones solamente se podían mover en órbitas específicas, cada una de las cuales caracterizada por su nivel energético. Cada órbita puede entonces identificarse mediante un número entero n que toma valores desde 1 en adelante. Este número "n" recibe el nombre de Número Cuántico Principal.
En este modelo los electrones giran en órbitas circulares alrededor del núcleo, ocupando la órbita de menor energía posible, o sea la órbita más cercana al núcleo posible. El electromagnetismo clásico predecía que una partícula cargada moviéndose de forma circular emitiría energía por lo que los electrones deberían colapsar sobre el núcleo en breves instantes de tiempo. Para superar este problema Bohr supuso que los electrones solamente se podían mover en órbitas específicas, cada una de las cuales caracterizada por su nivel energético. Cada órbita puede entonces identificarse mediante un número entero n que toma valores desde 1 en adelante. Este número "n" recibe el nombre de Número Cuántico Principal.
Bohr supuso además que el momento angular de cada electrón estaba cuantizado y sólo podía variar en fracciones enteras de la constante de Planck. De acuerdo al número cuántico principal calculó las distancias a las cuales se hallaba del núcleo cada una de las órbitas permitidas en el átomo de hidrógeno.
Estos niveles en un principio estaban clasificados por letras que empezaban en la "K" y terminaban en la "Q". Posteriormente los niveles electrónicos se ordenaron por números. Cada órbita tiene electrones con distintos niveles de energía obtenida que después se tiene que liberar y por esa razón el electrón va saltando de una órbita a otra hasta llegar a una que tenga el espacio y nivel adecuado, dependiendo de la energía que posea, para liberarse sin problema y de nuevo volver a su órbita de origen.
El modelo atómico de Bohr constituyó una de las bases fundamentales de la mecánica cuántica. Explicaba la estabilidad de la materia y las características principales del espectro de emisión del hidrógeno. Sin embargo no explicaba el espectro de estructura fina que podría ser explicado algunos años más tarde gracias al modelo atómico de Sommerfeld. Históricamente el desarrollo del modelo atómico de Bohr junto con la dualidad onda-corpúsculo permitiría a Erwin Schrödinger descubrir la ecuación fundamental de la mecánica cuántica.

Se puede demostrar que este conjunto de hipótesis corresponde a la hipótesis de que los electrones estables orbitando un átomo están descritos por funciones de onda estacionarias.
En la naturaleza existen 92 clases de átomos diferentes y el hombre fabricó algunos más, con lo que el número se eleva actualmente a unos 109, y hay posibilidades de que sean creados todavía más. Los átomos se diferencian en la cantidad de electrones, de protones y de neutrones. Veamos algunos ejemplos:
 El número atómico se representa con la letra Z y su valor es el total de electrones que hay en el átomo. Recordemos que en todo elemento el número de electrones es igual al de protones, por lo que decimos que el átomo es eléctricamente neutro Entonces el número atómico también indica la cantidad de protones.
El número atómico se representa con la letra Z y su valor es el total de electrones que hay en el átomo. Recordemos que en todo elemento el número de electrones es igual al de protones, por lo que decimos que el átomo es eléctricamente neutro Entonces el número atómico también indica la cantidad de protones.
 El otro número del "documento" es el número másico, se representa con la letra A, indica la sumatoria de protones y neutrones que hay en el núcleo. Con estos dos números sabremos todo acerca de un átomo.
El otro número del "documento" es el número másico, se representa con la letra A, indica la sumatoria de protones y neutrones que hay en el núcleo. Con estos dos números sabremos todo acerca de un átomo.
Veamos un ejemplo en el que pondremos en práctica lo que acabamos de ver: el átomo de Litio, (Li) tiene un número atómico igual a tres, es decir, Z = 3, y su número másico es A = 7, lo que indica:
Como el número de protones + neutrones = 7, si a esta cifra le restamos el número de protones (3), obtenemos la cantidad de neutrones: 4. O sea:
Número másico = Número de protones (número atómico) + Número de neutrones
O lo que es lo mismo: A = Z + N
Número de neutrones = Número másico – Número de protones
Es decir N = A - Z
Los electrones se distribuyen alrededor del núcleo como lo hacen los planetas del sistema solar alrededor del sol. Cada órbita, se denomina nivel. Podemos calcular la cantidad de electrones que hay en cada nivel, teniendo en cuenta que en cada uno hay un máximo, dado por la expresión 2.n2donde n es el número de nivel. Cada nivel se identifica con una letra, desde la K hasta la Q, así, veamos la distribución de electrones en un átomo:
Así, continuando con nuestro estudio del átomo de Li, procesaremos toda la información disponible:
Por lo tanto tendremos 2 niveles (Como en el primer nivel no "caben" más que dos electrones y ya sabemos que hay tres, el electrón sobrante tendrá que ir al segundo nivel).
Entonces la distribución de los electrones será 2 en el primer nivel, 1 en el segundo.


Átomo con sus 7 niveles
Podemos observar los protones dentro del núcleo al igual que los neutrones y los electrones en sus respectivos niveles.
Las distribuciones electrónicas sirven para ubicar a los electrones en los correspondientes niveles y subniveles de energía y orbitales.

Los niveles K, L, M, N, O, P y Q toman valores de 1, 2, 3, 4, 5, 6 y 7 respectivamente; y los subniveles de energía se corresponden con las letras s, p, d,f.
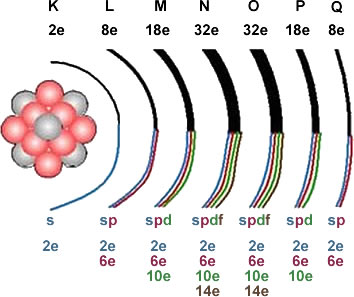
Conociendo el número atómico de un elemento químico, se puede hallar la distribución que sus electrones toman en los subniveles, según el orden ascendente de energía. Para realizar la distribución electrónica de un elemento, se debe tener en cuenta que los electrones ocupan primero los subniveles de menor energía, en orden ascendente.
Para ello, lo mejor es utilizar la regla mnemotécnica del diagrama de Moeller:
 El orden de llenado de orbitales que se obtiene a partir del diagrama de Moeller es:
El orden de llenado de orbitales que se obtiene a partir del diagrama de Moeller es:
Para utilizar la Regla de Diagonales utiliza las siguientes instrucciones:
1. Escribe el símbolo químico del elemento que deseas configurar
4. Sigue avanzando como te indican las flechas de la Regla de Diagonales y no olvides que no puedes avanzar hasta que el orbital esté completamente lleno.
En la capa 1 o K tenemos dos electrones en el orbital "s".
En el nivel de energía 2 o L en el orbital "s" tenemos dos electrones y en la misma capa pero en el orbital "p" hay seis electrones.
Ahora en la capa 3 o M tenemos el otro orbital "s" con dos electrones.
Sin embargo aún no está neutralizado el núcleo del Estroncio.
Ya que para obtener un número igual al del número atómico del elemento se deben sumar todos los exponentes (que son los electrones). Sólo el último orbital puede quedar con menor cantidad de electrones, que su máxima capacidad.

Modelo Atómico de Rutherford
Experimento de RutherfordEn 1911, Rutherford y sus colaboradores bombardearon una fina lámina de oro con partículas alfa (positivas), procedentes de un material radiactivo, a gran velocidad. El experimento permitió observar el siguiente comportamiento en las partículas lanzadas:
La mayor parte de ellas atravesaron la lámina sin cambiar de dirección, como era de esperar. Algunas se desviaron considerablemente. Unas pocas partículas rebotaron hacia la fuente de emisión.

De acuerdo con el Modelo de Thomson, en el cual la carga positiva de cada átomo está distribuida de forma homogénea, las partículas positivas que atraviesan la lámina no deberían ser apreciablemente desviadas de su trayectoria inicial. Evidentemente, esto no ocurría. En el Modelo de Rutherford la carga positiva está concentrada en un núcleo central, de manera que las partículas positivas que pasan muy cerca de él, se desvían bastante de su trayectoria inicial y sólo aquellas pocas que chocan directamente con el núcleo regresan en la dirección de la que proceden.
El átomo tiene una zona central o núcleo donde se encuentra la carga total positiva y la mayor parte de la masa del átomo. Además presenta una zona externa o corteza donde se hallan los electrones, que giran alrededor del núcleo. (Realmente, las partículas del núcleo (protones y neutrones) se descubrieron después de que Rutherford estableciera su modelo. El experimento de Rutherford sólo informaba de un núcleo pequeño y positivo, no aclaraba nada más).

El átomo estaba formado por un espacio fundamentalmente vacío, ocupado por electrones que giran a gran velocidad alrededor de un núcleo central muy denso y pequeño.
Mediante diversos experimentos se comprobó que la masa cargas positivas y electrones no coincidía con la masa total del átomo; por tanto, Rutherford supuso que tenía que haber otro tipo de partícula subatómica en el interior de los átomos.
Estas partículas se descubrieron en 1932. Al no tener carga eléctrica recibieron el nombre de neutrones.
Modelo Atómico de Bohr
En el siglo XVII, Isaac Newton demostró que la luz blanca visible procedente del sol puede descomponerse en sus diferentes colores mediante un prisma. El espectro que se obtiene es continuo; contiene todas las longitudes de onda desde el rojo al violeta.En cambio la luz emitida por un gas incandescente no es blanca sino coloreada y el espectro que se obtiene al hacerla pasar a través de un prisma es bastante diferente. Es un espectro discontinuo que consta de líneas o rayas emitidas a longitudes de onda específicas. Cada elemento (es decir cada tipo de átomos) posee un espectro característico que puede utilizarse para identificarlo.
Uno de los espectros atómicos más sencillos, y que más importancia tuvo desde un punto de vista teórico, es el del hidrógeno. Cuando los átomos de gas hidrógeno absorben energía por medio de una descarga de alto voltaje, emiten radiaciones que dan lugar a 5 líneas en la región visible del espectro:

Describió el átomo de hidrógeno con un protón en el núcleo, y girando a su alrededor un electrón. El modelo atómico de Bohr partía conceptualmente del modelo atómico de Rutherford y de las incipientes ideas sobre cuantización que habían surgido unos años antes con las investigaciones de Max Planck y Albert Einstein. Debido a su simplicidad el modelo de Bohr es todavía utilizado frecuentemente como una simplificación de la estructura de la materia.

Bohr supuso además que el momento angular de cada electrón estaba cuantizado y sólo podía variar en fracciones enteras de la constante de Planck. De acuerdo al número cuántico principal calculó las distancias a las cuales se hallaba del núcleo cada una de las órbitas permitidas en el átomo de hidrógeno.
Estos niveles en un principio estaban clasificados por letras que empezaban en la "K" y terminaban en la "Q". Posteriormente los niveles electrónicos se ordenaron por números. Cada órbita tiene electrones con distintos niveles de energía obtenida que después se tiene que liberar y por esa razón el electrón va saltando de una órbita a otra hasta llegar a una que tenga el espacio y nivel adecuado, dependiendo de la energía que posea, para liberarse sin problema y de nuevo volver a su órbita de origen.
El modelo atómico de Bohr constituyó una de las bases fundamentales de la mecánica cuántica. Explicaba la estabilidad de la materia y las características principales del espectro de emisión del hidrógeno. Sin embargo no explicaba el espectro de estructura fina que podría ser explicado algunos años más tarde gracias al modelo atómico de Sommerfeld. Históricamente el desarrollo del modelo atómico de Bohr junto con la dualidad onda-corpúsculo permitiría a Erwin Schrödinger descubrir la ecuación fundamental de la mecánica cuántica.
Postulados de Bohr
En 1913 Niels Bohr desarrolló su célebre modelo atómico de acuerdo a 4 postulados fundamentales:- Los electrones orbitan en el átomo en niveles discretos y cuantizados de energía, es decir, no todas las órbitas están permitidas, tan sólo un número finito de éstas.
- Los electrones pueden saltar de un nivel electrónico a otro sin pasar por estados intermedios.
- El salto de un electrón de un nivel cuántico a otro implica la emisión o absorción de un único cuanto de luz (fotón) cuya energía corresponde a la diferencia de energía entre ambas órbitas.
- Las órbitas permitidas tienen valores discretos o cuantizados del momento angular orbitalL de acuerdo con la siguiente ecuación:

- Donde n = 1,2,3,… es el número cuántico angular o número cuántico principal.
Se puede demostrar que este conjunto de hipótesis corresponde a la hipótesis de que los electrones estables orbitando un átomo están descritos por funciones de onda estacionarias.
Estructuras Atómicas
En la naturaleza existen 92 clases de átomos diferentes y el hombre fabricó algunos más, con lo que el número se eleva actualmente a unos 109, y hay posibilidades de que sean creados todavía más. Los átomos se diferencian en la cantidad de electrones, de protones y de neutrones. Veamos algunos ejemplos:
- El Hidrógeno está formado por un electrón y un protón.
- El Helio posee dos electrones, dos protones y dos neutrones.
- El Litio tiene tres protones, cuatro neutrones y tres electrones.
El D. N. I. de un átomo
La cantidad de electrones, protones y neutrones, permiten confeccionar el “documento de identidad de un átomo”, y que lo hace perfectamente identificable, tal como ocurre con las personas, en que el número de documento de una persona, no coincide con el de ninguna otra. En el "documento" del átomo constan dos números: el número atómico (Z) y el número másico (A).

Veamos un ejemplo en el que pondremos en práctica lo que acabamos de ver: el átomo de Litio, (Li) tiene un número atómico igual a tres, es decir, Z = 3, y su número másico es A = 7, lo que indica:
 | electrones = 3 protones = 3 protones + neutrones = 7 |
Número másico = Número de protones (número atómico) + Número de neutrones
O lo que es lo mismo: A = Z + N
Número de neutrones = Número másico – Número de protones
Es decir N = A - Z
Los electrones
| n | 2.n2 | Letra |
| 1 | 2.12=2 | K |
| 2 | 2.22=8 | L |
| 3 | 2.32=18 | M |
| 4 | 2.42=32 | N |
| 5 | 2.52=50 | O |
| 6 | 2.62=72 | P |
| 7 | 2.72=98 | Q |
 | electrones = 3 protones = 3 protones + neutrones = 7 |
Entonces la distribución de los electrones será 2 en el primer nivel, 1 en el segundo.

Representación gráfica de un átomo
Con toda esta información estamos en condiciones de representar esquemáticamente un átomo:
Átomo con sus 7 niveles
Distribuciones Electrónicas
Las distribuciones electrónicas sirven para ubicar a los electrones en los correspondientes niveles y subniveles de energía y orbitales.

Los niveles K, L, M, N, O, P y Q toman valores de 1, 2, 3, 4, 5, 6 y 7 respectivamente; y los subniveles de energía se corresponden con las letras s, p, d,f.

Conociendo el número atómico de un elemento químico, se puede hallar la distribución que sus electrones toman en los subniveles, según el orden ascendente de energía. Para realizar la distribución electrónica de un elemento, se debe tener en cuenta que los electrones ocupan primero los subniveles de menor energía, en orden ascendente.
Para ello, lo mejor es utilizar la regla mnemotécnica del diagrama de Moeller:

Para utilizar la Regla de Diagonales utiliza las siguientes instrucciones:
1. Escribe el símbolo químico del elemento que deseas configurar
Sr (Estroncio)
2. Coloca como superíndice izquierdo el número atómico de ese elemento (el número atómico indica las cargas positivas del núcleo, los protones).
38Sr
3. Utilizando la "Regla de Diagonales" distribuye los electrones que necesitas para neutralizar la carga positiva del núcleo atómico (en este ejemplo son 38 e-). Comienza en la posición 1s que será llenado con los electrones que caben en ese orbital (recuerda que el orbital "s" con 2 electrones; p con 6 e- ; d con 10 y f con 14). Escribe la cantidad de electrones que caben en ese orbital con el número en forma de exponente.
38Sr = 1s2
En este momento tenemos neutralizados 2 protones con los dos electrones localizados en el 1ernivel de energía y en el orbital "s"4. Sigue avanzando como te indican las flechas de la Regla de Diagonales y no olvides que no puedes avanzar hasta que el orbital esté completamente lleno.
38Sr = 1s2, 2s2, 2p6, 3s2
Esta configuración describe lo siguiente:En la capa 1 o K tenemos dos electrones en el orbital "s".
En el nivel de energía 2 o L en el orbital "s" tenemos dos electrones y en la misma capa pero en el orbital "p" hay seis electrones.
Ahora en la capa 3 o M tenemos el otro orbital "s" con dos electrones.
Sin embargo aún no está neutralizado el núcleo del Estroncio.
Ya que para obtener un número igual al del número atómico del elemento se deben sumar todos los exponentes (que son los electrones). Sólo el último orbital puede quedar con menor cantidad de electrones, que su máxima capacidad.
38Sr = 1s2, 2s2, 2p6, 3s2, 3p6, 4s2, 3d10, 4p6, 5s2
En el próximo tema veremos como verificar si esta configuración está correcta haciendo uso de la tabla periódica
Primeras clasificaciones periódicas.
Cuando a principios del siglo XIX se midieron las masas atómicas de una gran cantidad de elementos, se observó que ciertas propiedades variaban periódicamente en relación a su masa. De esa manera, hubo diversos intentos de agrupar los elementos, todos ellos usando la masa atómica como criterio de ordenación.
La clasificación de Mendeleiev es la mas conocida y elaborada de todas las primeras clasificaciones periódicas. Clasificó lo 63 elementos conocidos hasta entonces utilizando el criterio de masa atómica usado hasta entonces, ya que hasta bastantes años después no se definió el concepto de número atómico puesto que no se habían descubierto los protones.

Su tabla periódica dejaba espacios vacíos, que él consideró que se trataba de elementos que aún no se habían descubierto. Así, predijo las propiedades de algunos de éstos, tales como el germanio (Ge), al que Mendeleiev llamó ekasilicio. Cuando todavía en vida de Mendeleiev se descubrió el Ge que tenía las propiedades previstas por éste, su clasificación periódica adquirió gran prestigio.
Otro de los inconvenientes que poseía la tabla de Mendeleiev era que algunos elementos tenía que colocarlos en desorden de masa atómica para que coincidieran las propiedades. Él lo atribuyó a que las masas atómicas estaban mal medidas. Así, por ejemplo, colocó el teluro (Te) antes que el yodo (I) a pesar de que la masa atómica de éste era menor que la de aquel. Hoy sabemos que las masas atómicas estaban bien medidas y que el problemas era el criterio de clasificación hasta entonces usado.
Myspace Photo Cube

No hay comentarios:
Publicar un comentario